Polarisation et décisions binaires du destin cellulaire dans le système nerveux
Nous analysons comment les divisions des progéniteurs neuronaux sont régulées et comment les neurones différenciés sont produits de manière robuste.
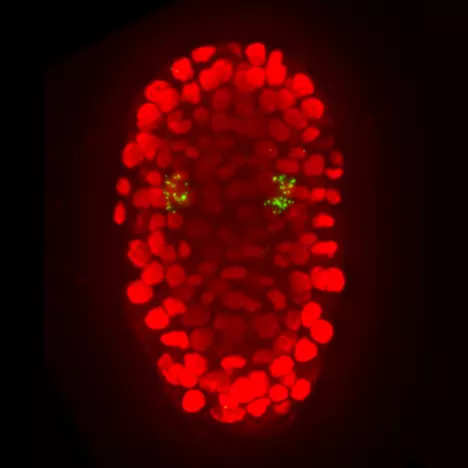
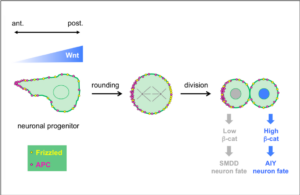
Les neurones sont souvent générés par des divisions asymétriques de progéniteurs neuronaux tels que les cellules souches neurales. Au cours de ce processus, une cellule progénitrice se divise de manière asymétrique pour générer deux neurones d’identité différente, ou un neurone et un nouveau progéniteur. Dans le système nerveux, les divisions asymétriques des différents progéniteurs sont étroitement coordonnées, ce qui implique une communication entre les cellules. En outre, au cours du développement du système nerveux, un ensemble très précis de différents types de neurones est produit, ce qui signifie que leur processus de spécification doit être très robuste.
Notre équipe analyse comment les divisions asymétriques des progéniteurs neuronaux sont contrôlées et comment divers types de neurones différenciés sont produits de manière robuste. Pour répondre à ces questions, nous utilisons le nématode C. elegans comme organisme modèle. C. elegans est un bon système pour étudier ce processus car son système nerveux est simple et bien caractérisé. En outre, chez C. elegans, l’histoire de la lignée de chaque neurone est connue, les embryons sont transparents et leur développement peut être facilement suivi par vidéomicroscopie 4D. Le système C. elegans offre également de nombreux outils pour disséquer les bases moléculaires des processus biologiques tels que les cribles à l’échelle du génome, la transgénèse ou l’ingénierie génomique CRISPR. La combinaison de l’ingénierie des génomes et de l’imagerie quantitative en live nous permet de suivre la dynamique des protéines et de l’expression des gènes in vivo pendant le développement du système nerveux.
En caractérisant les mécanismes contrôlant les divisions et la différenciation des progéniteurs neuronaux, nos travaux pourraient avoir un impact sur le développement de traitements contre certains types de cancer ou de maladies neurodégénératives.
Publications
Left/right asymmetrically expressed ephrin and Flamingo proteins regulate lateralized axon growth in C. elegans.
PRC1 chromatin factors strengthen the consistency of neuronal cell fate specification and maintenance in C. elegans
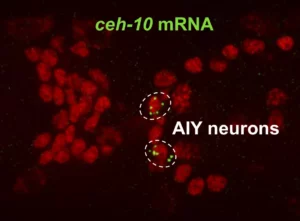
Multiple neural bHLHs ensure the precision of a neuronal specification event in Caenorhabditis elegans
Imaging of native transcription and transcriptional dynamics in vivo using a tagged Argonaute protein
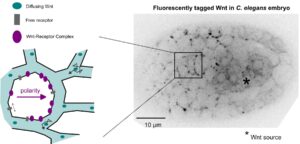
Wnt ligands regulate the asymmetric divisions of neuronal progenitors in C. elegans embryos
Atypical transcriptional activation by TCF via a Zic transcription factor in C. elegans neuronal precursors_edited
Left/right asymmetrically expressed ephrin and Flamingo proteins regulate lateralized axon growth in C. elegans.
Transfer of polarity information via diffusion of Wnt ligands in C. elegans embryos
Labelling of Active Transcription Sites with Argonaute NRDE-3-Image Active Transcription Sites in vivo in Caenorhabditis elegans
PRC1 chromatin factors strengthen the consistency of neuronal cell fate specification and maintenance in C. elegans
Multiple neural bHLHs ensure the precision of a neuronal specification event in Caenorhabditis elegans
Imaging of native transcription and transcriptional dynamics in vivo using a tagged Argonaute protein
Neuronal specification in C. elegans: combining lineage inheritance with intercellular signaling
Wnt ligands regulate the asymmetric divisions of neuronal progenitors in C. elegans embryos
Zic Genes in Nematodes: A Role in Nervous System Development and Wnt Signaling
Zic-proteins are repressors of dopaminergic forebrain fate in mice and C. elegans
β-catenin-driven binary cell fate decisions in animal development
How targets select activation or repression in response to Wnt_edited
Atypical transcriptional activation by TCF via a Zic transcription factor in C. elegans neuronal precursors_edited
Setting-up a simple light sheet microscope for in toto imaging of C. elegans development
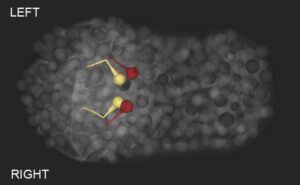
Notch-dependent induction of left/right asymmetry in C. elegans interneurons and motoneurons.
Lineage programming: navigating through transient regulatory states via binary decisions.
Analysis of multiple ethyl methanesulfonate-mutagenized Caenorhabditis elegans strains by whole-genome sequencing
Wnt asymmetry and the terminal division of neuronal progenitors.
Linking asymmetric cell division to the terminal differentiation program of postmitotic neurons in C. elegans.
Actualités
Des asymétries cachées dans le cerveau
Et pourtant ils diffusent!
Dans les embryons de C. elegans les ligands Wnt diffusent dans le tissu pour polariser des cellules à distance.
Fais ton stage à l’IBDM !
Tu es à la recherche de ton stage de Master ? L’IBDM te semble être le bon endroit pour le faire ? Découvre nos offres dès maintenant.
Des facteurs chromatiniens PRC1 assurent la robustesse de la différenciation des neurones
L’équipe Bertrand a identifié un role pour des facteurs chromatiniens PRC1 dans la robustesse de l’identité des neurones contre le bruit dans l’expression des gènes et les perturbations environnementales.
7 équipes de l’IBDM ont reçu une bourse ANR
7 équipes de l’IBDM ont reçu des subventions de l’Agence Nationale pour la Recherche (ANR) en 2021. Félicitations à Vincent Bertrand, Harold Cremer, Pascale Durbec,
Antoine Barrière et Amel Toudji-Zouaz de l’équipe Bertrand ont développé une nouvelle méthode permettant de visualiser la transcription des gènes in vivo.
Dans une étude collaborative publiée dans Development, les équipes de Vincent Bertrand et de Pierre-François Lenne ont analysé le rôle de ligands Wnt lors des divisions générant des neurones au cours du développement du système nerveux.
During this master project (M1 or M2), the student will analyze the dynamics of PRC1 dots during neuronal specification and maintenance by in vivo time-lapse imaging, and characterize the nature of these dots.
Un poste de docteur sur la robustesse des programmes de spécification du destin cellulaire – Bertrand Lab (juin 2022) à l’Institut de Biologie du Développement