Contrôle génétique du développement du cœur
Notre équipe étudie le développement du cœur afin d'identifier les mécanismes biologiques qui sous-tendent l'organogenèse, la régénération et les maladies congénitales.
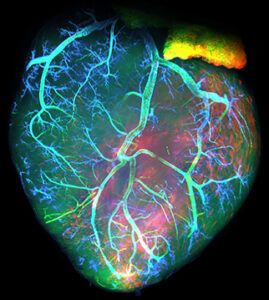
Apprendre comment les organes se forment dans l’embryon est essentiel pour comprendre les origines des maladies congénitales et pour développer des approches pour réparer les tissus adultes après un dommage. Le cœur est le premier organe à se former et à fonctionner chez l’embryon et le développement cardiaque implique des interactions complexes entre les gènes, les populations de cellules progénitrices et les événements de signalisation intercellulaire. Cette complexité se reflète dans le fait que les malformations cardiaques congénitales touchent 1 naissance sur 100. Notre groupe étudie le développement du cœur chez la souris, où la séquence d’événements développementaux est très similaire à celle de l’homme, en se concentrant sur deux domaines critiques.
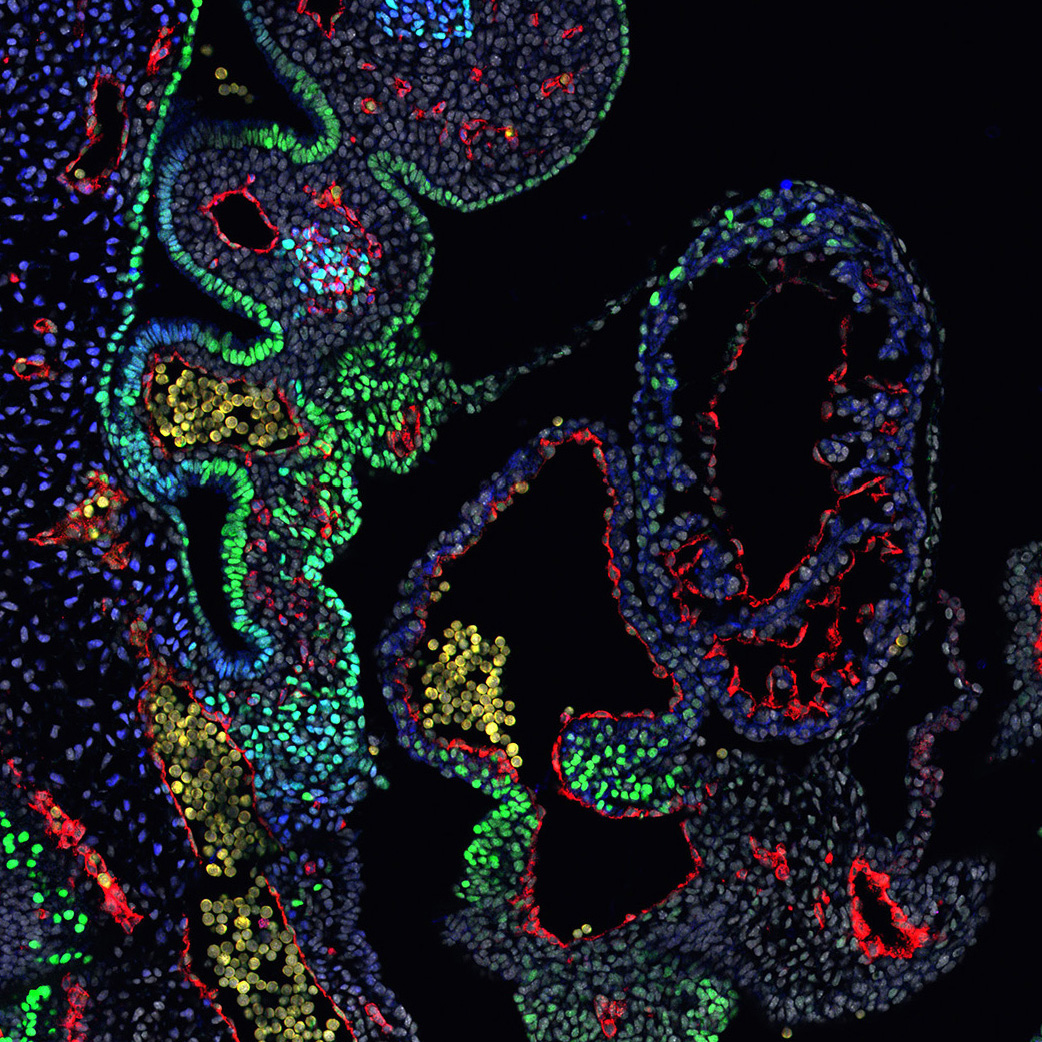
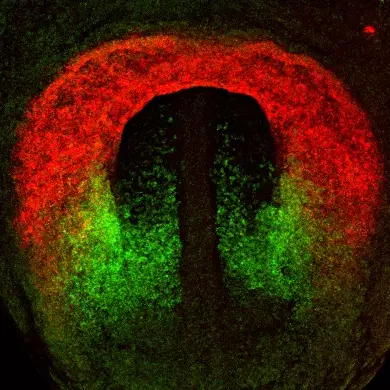
Premièrement, nous étudions la croissance du cœur embryonnaire par l’ajout progressif de myocarde à partir de cellules progénitrices connues sous le nom de deuxième champ cardiaque (SHF). Les parties du cœur dérivées du SHF sont des points chauds pour les défauts cardiaques congénitaux communs. Nous étudions les propriétés des cellules SHF et les mécanismes pilotant leur déploiement dans le cœur. Le programme génétique de la SHF est partagé avec les cellules progénitrices du muscle de la tête, et nous étudions également comment un programme commun diverge pour donner naissance aux muscles du cœur et de la tête.
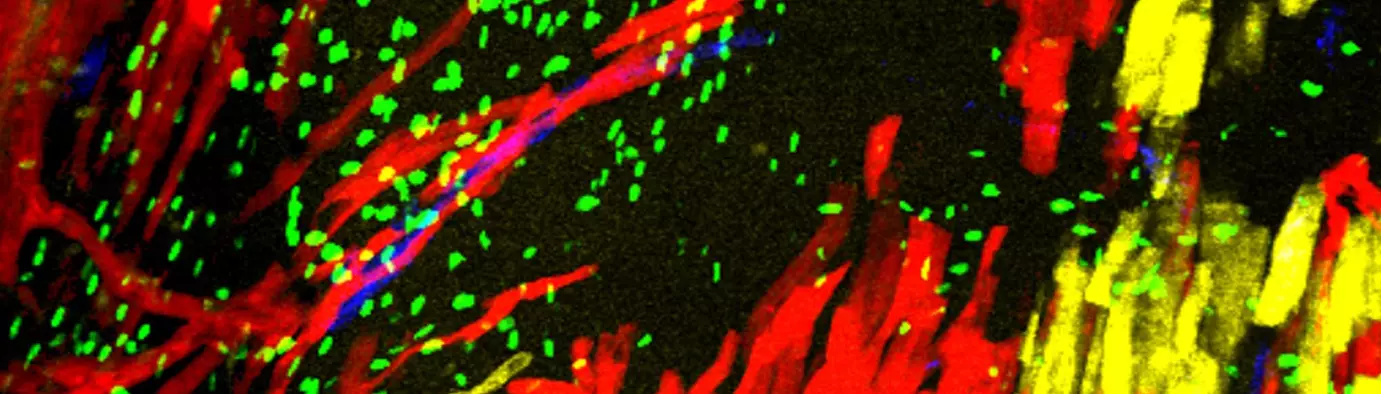
Deuxièmement, nous étudions le développement du système de conduction cardiaque qui forme le câblage électrique du cœur et coordonne les battements cardiaques. Le système de conduction est dérivé de cellules progénitrices communes avec les cardiomyoctyles contractiles du cœur et nous étudions les mécanismes cellulaires et génétiques nécessaires à l’établissement de ces myocytes spécialisés au cours du développement normal et dans des conditions pathologiques.
Publications
Nkx2-5 defines distinct scaffold and recruitment phases during formation of the murine cardiac Purkinje fiber network
Cardiopharyngeal mesoderm origins of musculoskeletal and connective tissues in the mammalian pharynx
T-box genes and retinoic acid signaling regulate the segregation of arterial and venous pole progenitor cells in the murine second heart field
Deletion of Nkx2-5 in trabecular myocardium reveals the developmental origins of pathological heterogeneity associated with ventricular non-compaction cardiomyopathy
Epithelial tension in the second heart field promotes mouse heart tube elongation.
Tbx1 Coordinates Addition of Posterior Second Heart Field Progenitor Cells to the Arterial and Venous Poles of the Heart
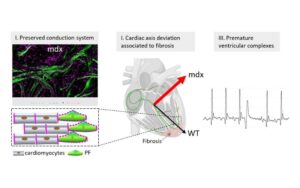
Conduction defects and arrhythmias in mdx mice are not associated with a degeneration of the cardiac Purkinje network
Single-cell morphometrics reveals T-box gene-dependent patterns of epithelial tension in the Second Heart field
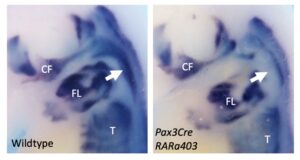
Retinoic acid signalling regulates branchiomeric neck muscle development at the head/trunk interface
Transient formation of collaterals contributes to the restoration of the arterial tree during cardiac regeneration in neonatal mice
Nkx2-5 loss of function in the his-purkinje system hampers its maturation and leads to mechanical dysfunction
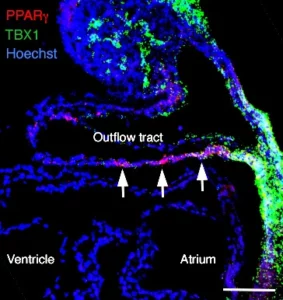
PPARγ and NOTCH Regulate Regional Identity in the Murine Cardiac Outflow Tract
Capturing Cardiogenesis in Gastruloids
Nkx2-5 defines distinct scaffold and recruitment phases during formation of the murine cardiac Purkinje fiber network
Hox-dependent coordination of mouse cardiac progenitor cell patterning and differentiation
A Second Heart Field-Derived Vasculogenic Niche Contributes to Cardiac Lymphatics
Cardiopharyngeal mesoderm origins of musculoskeletal and connective tissues in the mammalian pharynx
Straightjacket/α2δ3 deregulation is associated with cardiac conduction defects in myotonic dystrophy type 1
Defects in Trabecular Development Contribute to Left Ventricular Noncompaction
Tbx1 regulates extracellular matrix-cell interactions in the second heart field
A single-cell transcriptional roadmap for cardiopharyngeal fate diversification
Loss of Tbx3 in murine neural crest reduces enteric glia and causes cleft palate, but does not influence heart development or bowel transit
Unique morphogenetic signatures define mammalian neck muscles and associated connective tissues
T-box genes and retinoic acid signaling regulate the segregation of arterial and venous pole progenitor cells in the murine second heart field
Embryonic Tbx3 + cardiomyocytes form the mature cardiac conduction system by progressive fate restriction
Deletion of Nkx2-5 in trabecular myocardium reveals the developmental origins of pathological heterogeneity associated with ventricular non-compaction cardiomyopathy
Epithelial Properties of the Second Heart Field
Epithelial tension in the second heart field promotes mouse heart tube elongation.
Coronary stem development in wildtype and Tbx1 null mouse hearts.
Revascularization of the heart after infarct: lessons from embryonic development.
Congenital coronary artery anomalies: a bridge from embryology to anatomy and pathophysiology–a position statement of the development, anatomy, and pathology ESC Working Group.
A Cranial Mesoderm Origin for Esophagus Striated Muscles.
Adhesive Enrichment and Membrane Turnover at the Heart of Cardiopharyngeal Induction.
Optogenetic determination of the myocardial requirements for extrasystoles by cell type-specific targeting of ChannelRhodopsin-2.
Endothelial Plasticity Drives Arterial Remodeling Within the Endocardium After Myocardial Infarction
A new heart for a new head in vertebrate cardiopharyngeal evolution.
Loss of Wnt5a disrupts second heart field cell deployment and may contribute to OFT malformations in DiGeorge syndrome.
Clonal analysis reveals a common origin between nonsomite-derived neck muscles and heart myocardium.
FGF10 promotes regional foetal cardiomyocyte proliferation and adult cardiomyocyte cell-cycle re-entry.
TBX1 regulates epithelial polarity and dynamic basal filopodia in the second heart field.
Tbx1 Coordinates Addition of Posterior Second Heart Field Progenitor Cells to the Arterial and Venous Poles of the Heart
Prdm1 functions in the mesoderm of the second heart field, where it interacts genetically with Tbx1, during outflow tract morphogenesis in the mouse embryo
Cardiac arrhythmia induced by genetic silencing of ‘funny’ (f) channels is rescued by GIRK4 inactivation.
Resolving cell lineage contributions to the ventricular conduction system with a Cx40-GFP allele: a dual contribution of the first and second heart fields.
Second heart field cardiac progenitor cells in the early mouse embryo.
Fibroblast growth factor 10 gene regulation in the second heart field by Tbx1, Nkx2-5, and Islet1 reveals a genetic switch for down-regulation in the myocardium.
The effect of connexin40 deficiency on ventricular conduction system function during development.
Epistatic rescue of Nkx2.5 adult cardiac conduction disease phenotypes by prospero-related homeobox protein 1 and HDAC3.
Remodeling of the peripheral cardiac conduction system in response to pressure overload.
Identification of a Tbx1/Tbx2/Tbx3 genetic pathway governing pharyngeal and arterial pole morphogenesis.
Contemporary cardiogenesis: new insights into heart development.
Tbx1, subpulmonary myocardium and conotruncal congenital heart defects.
Inducible Cx40-Cre expression in the cardiac conduction system and arterial endothelial cells.
Clonal analysis reveals common lineage relationships between head muscles and second heart field derivatives in the mouse embryo.
Biphasic development of the mammalian ventricular conduction system.
Hes1 expression is reduced in Tbx1 null cells and is required for the development of structures affected in 22q11 deletion syndrome.
Decreased levels of embryonic retinoic acid synthesis accelerate recovery from arterial growth delay in a mouse model of DiGeorge syndrome.
Role of mesodermal FGF8 and FGF10 overlaps in the development of the arterial pole of the heart and pharyngeal arch arteries.
Megavoltage planar and cone-beam imaging with low-Z targets: dependence of image quality improvement on beam energy and patient separation.
Hes1 is expressed in the second heart field and is required for outflow tract development.
Distinct regulatory cascades govern extraocular and pharyngeal arch muscle progenitor cell fates.
Signaling pathways controlling second heart field development.
Relationship between neural crest cells and cranial mesoderm during head muscle development.
Properties of branchiomeric and somite-derived muscle development in Tbx1 mutant embryos.
The del22q11.2 candidate gene Tbx1 controls regional outflow tract identity and coronary artery patterning.
Integration of embryonic and fetal skeletal myogenic programs at the myosin light chain 1f/3f locus.
Myocardium at the base of the aorta and pulmonary trunk is prefigured in the outflow tract of the heart and in subdomains of the second heart field.
Visualization of outflow tract development in the absence of Tbx1 using an FgF10 enhancer trap transgene.
Congenital heart defects in Fgfr2-IIIb and Fgf10 mutant mice.
Left and right ventricular contributions to the formation of the interventricular septum in the mouse heart.
Rotation of the myocardial wall of the outflow tract is implicated in the normal positioning of the great arteries.
The del22q11.2 candidate gene Tbx1 regulates branchiomeric myogenesis.
Tbx2 is essential for patterning the atrioventricular canal and for morphogenesis of the outflow tract during heart development.
The clonal origin of myocardial cells in different regions of the embryonic mouse heart.
Cell history determines the maintenance of transcriptional differences between left and right ventricular cardiomyocytes in the developing mouse heart.
The anterior heart-forming field: voyage to the arterial pole of the heart.
The arterial pole of the mouse heart forms from Fgf10-expressing cells in pharyngeal mesoderm.
Actualités
Une étude remet en question le rôle des fibres de Purkinje dans les arythmies cardiaques de la myopathie de Duchenne.
Le développement du muscle trapèze nécessite une interaction entre le mésoderme pharyngien et le mésoderme somitique chez l’embryon précoce de souris.
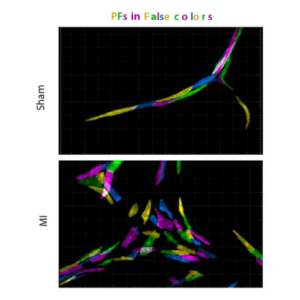
La régénération cardiaque entraîne une hyperplasie du réseau de fibres de Purkinje et des troubles de la conduction ventriculaire.
Pendant la régénération cardiaque, des collatérales se forment pour perfuser la zone infarcie et réparer l’artère coronaire.
Félicitation à Robert Kelly, Frank Schnorrer, Cédric Maurange, Bianca Habermann et Delphine Delacour !
L’équipe Kelly publie dans Nature Com. une étude réalisée par C. Choquet et L. Miquerol sur la mise en place des fibres de Purkinje cardiaques qui servent de cables électriques dans les ventricules pour synchroniser les battements cardiaques.
Cardiopharyngeal mesoderm origins of musculosketelal and connective tissues in the mammalian pharynx
Dans une étude publiée dans Development, Adachi et al ont utilisé le traçage du lignage génétique pour étudier l’origine cellulaire de la gorge chez la souris.
No jobs opportunities found..