Les malformations cardiaques congénitales concernent 1 naissance sur 100 et environ un tiers d’entre elles affectent la voie efférente cardiaque, où les grandes artères, l’aorte et le tronc pulmonaire, s’alignent avec les ventricules gauche et droit respectivement. Il a été démontré que le myocarde à la base de l’aorte et du tronc pulmonaire provient de régions distinctes de la voie efférente à mi-gestation et que cette régionalisation est établie dans les progéniteurs cardiaques chez l’embryon précoce, avant que ces cellules s’ajoutent progressivement au tube cardiaque.
Une perturbation génétique ou environnementale du déploiement des cellules progénitrices entraîne une malformation cardiaque congénitale chez l’homme et les modèles murins. Par exemple, le gène de la délétion 22q11.2 (également connu sous le nom de syndrome de DiGeorge), qui code pour le facteur de transcription TBX1, est exprimé dans le futur myocarde sous-pulmonaire et est requis pour l’ajout correct de ces cellules progénitrices au cœur.
En partant d’une analyse des gènes différentiellement exprimés dans la voie efférente cardiaque, Rammah et collègues du groupe Kelly “Contrôle génétique du développement du cœur” ont utilisé des approches in vitro et in vivo pour identifier le capteur de lipides PPAR comme un régulateur en aval de Tbx1 pour le développement du myocarde sous-pulmonaire. L’expression de PPAR est réprimée dans le futur myocarde sub-aortique par la voie de signalisation Notch, à travers les activités du facteur de transcription HES1 et du ligand non-canonique de Notch DLK1, un régulateur négatif de PPAR pendant l’adipogenèse.
Ces résultats révèlent comment des cascades de régulation complémentaires établissent l’identité régionale dans la voie efférente embryonnaire et préfigurent la septation ultérieure. En outre, ces résultats suggèrent l’importance des changements métaboliques et de l’interface gène-environnement au cours du développement du cœur.
Les perspectives soulevées par ce travail sont suivies dans le projet ANR Pp-heart en collaboration avec Magali Théveniau-Ruissy et Francesca Rochais dans l’unité de génétique médicale de Marseille (MMG), Aix Marseille Université.
En savoir plus
PPARγ and NOTCH Regulate Regional Identity in the Murine Cardiac Outflow Tract.
Rammah M, Théveniau-Ruissy M, Sturny R, Rochais F, Kelly RG.
Circ Res. 2022 Oct 7:101161CIRCRESAHA122320766.
doi: 10.1161/CIRCRESAHA.122.320766. Online ahead of print.
PMID: 362051
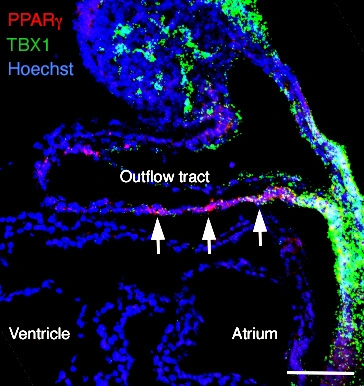
Légende de la figure
La figure montre l’accumulation régionalisée du transcrit PPAR g (rouge) dans la paroi inférieure de la voie efférente à mi-gestation et Tbx1 (vert) dans les cellules progénitrices cardiaques adjacentes. Coupe sagittale d’un embryon de souris au jour 9,5 ; barre d’échelle : 100 μm. Photo: Magali Théveniau-Ruissy.