Membres de l'équipe
Contrôle et dynamique du cycle ovarien
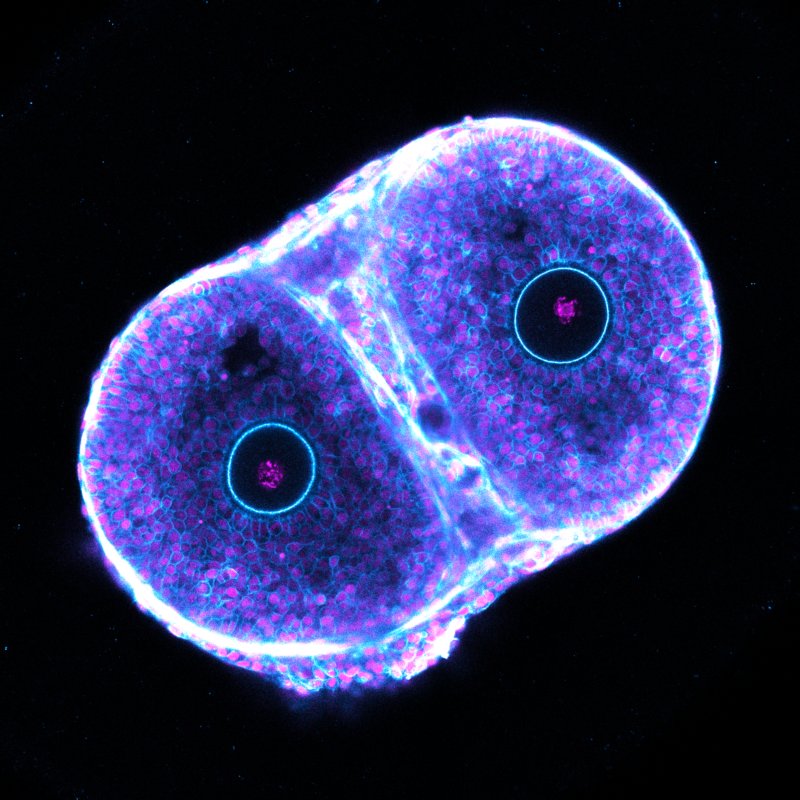
Notre équipe utilise des stratégies d'imagerie ex vivo pour modéliser le cycle ovarien, en étudiant comment la communication entre cellules et entre follicules assure la production d'un ovule fécondable.
L’origine de la nouvelle vie est l’une des questions les plus fondamentales de l’existence humaine. La contribution maternelle à cette nouvelle vie, l’ovule, est libérée d’un follicule ovarien lors de l’ovulation. Parmi les millions de follicules présents dans l’ovaire à la naissance, seule une petite fraction sera sélectionnée pour l’ovulation, et la plupart dégénéreront. Même parmi ceux sélectionnés, beaucoup ne parviennent pas à ovuler ou rencontrent des erreurs durant la première division méiotique de l’ovule, qui se produit au sein du follicule en ovulation. La perte massive de follicules, l’échec de l’ovulation et les erreurs méiotique sont des causes majeures du déclin de la fertilité avec l’âge maternel.
La fertilité féminine est régie par la communication entre l’ovule et les cellules folliculaires environnantes, ainsi que par la compétition entre les follicules dans l’ovaire. Comprendre comment les interactions à l’échelle cellulaire et tissulaire influencent la fonction reproductive nécessite une image détaillée de l’ovaire en cycle. Pourtant, malgré leur nature fondamentale et leurs implications médicales, comment les follicules grandissent, rivalisent et coordonnent l’ovulation et la méiose n’a jamais été étudié directement.
Avec des collègues dans mon précédent laboratoire, j’ai développé un modèle pour étudier les processus ovariens en direct dans des follicules de souris isolés, en utilisant un système de culture à long terme avec imagerie quantitative avancée. Cela a jeté les bases d’un travail révolutionnaire où nous avons visualisé le mécanisme de l’ovulation chez les mammifères (Thomas, Marx et al., 2024). Ce modèle offre une vue unique sur la dynamique de l’ovaire cyclique, nous permettant d’aborder des questions fondamentales sur la fertilité.
À l’IBDM, mon équipe s’appuie sur cette approche, développant des stratégies ex vivo pour découvrir comment les follicules rivalisent pour la sélection et comment la communication entre l’ovocyte et les cellules folliculaires garantit une coordination adéquate de l’ovulation et de la méiose.
Publications
Ex vivo imaging reveals the spatiotemporal control of ovulation.
Ex vivo imaging reveals the spatiotemporal control of ovulation.
Actualités
Nous adressons nos chaleureuses félicitations à Julia Schaeffer, Baptiste Libé-Philippot et Christopher Thomas.
No jobs opportunities found..