De l’homme à l’insecte, les muscles nous permettent de nous mouvoir et de pomper les fluides corporels. L’unité de production de force des muscles s’appelle le sarcomère. Tous les sarcomères contiennent trois éléments clés : de longs filaments d’actine parallèles, des moteurs à myosine qui rapprochent ces filaments d’actine afin de contracter le sarcomère, et de longues protéines élastiques, les titines, qui relient mécaniquement actines et myosines en définissent en même temps la longueur du sarcomère des mammifères. Une collaboration internationale dirigée par Frank Schnorrer à Marseille, Dirk Görlich à Göttingen et Ralf Jungmann à Munich a voulu examiner si la titine régit également la longueur des sarcomères des insectes. Pour y parvenir, les scientifiques ont combiné leurs compétences pour générer des outils qui marquent spécifiquement les extrémités des deux différentes titines présentes chez la drosophile, Drosophila melanogaster : avec des versions miniatures d’anticorps, appelées nanocorps, les scientifiques ont pu localiser les extrémités des deux homologues de la titine de la mouche, appelés Sallimus et Projectin, avec une précision de 5 nm. Cette haute résolution a révélé la localisation de versions courtes des homologues de la titine dans les sarcomères des muscles du vol, montrant une disposition décalée intéressante (voir image). En revanche, les longs sarcomères des larves de drosophile contiennent des versions longues de la protéine Sallimus. Les scientifiques ont conclu que, comme dans les muscles humains, la longueur et l’organisation des domaines des versions de la titine des insectes déterminent probablement les dimensions des sarcomères des insectes d’une manière spécifique au type de muscle.
L’architecture globale des sarcomères est conservée de la mouche à l’homme, mais tous ses composants ne sont pas identiques. La question de savoir comment les dimensions des sarcomères d’insectes sont déterminées par leurs composants reste donc ouverte. Une collaboration internationale financée par le European Research Council (ERC) a entrepris d’étudier l’architecture exacte des sarcomères d’insectes. Pour visualiser et mesurer les composants du sarcomère, Dirk Görlich et son équipe de l’Institut Max Planck des sciences multidisciplinaires de Göttingen ont créé des nanocorps (anticorps miniaturisés) qui se lient avec une grande spécificité à des régions choisies des protéines sarcomériques. La fonctionnalisation de ces nanocorps avec des molécules fluorescentes permet de les observer sous microscope.
Vincent Loreau et Eunice Chan, de l’Institut de biologie du développement de Marseille (IBDM), ont testé ces nanocorps dans des muscles de drosophile afin de vérifier leur liaison spécifique à leur protéine sarcomérique et de localiser la position des protéines sarcomériques dans différents types de muscles de la mouche. En utilisant des nanocorps qui reconnaissent spécifiquement le début ou la fin de l’homologue de la titine de la Drosophile, Sallimus (Sls), les chercheurs ont montré la présence de versions très longues de Sls ( >>2 micromètres) dans les muscles larvaires de la drosophile, corrélant avec la présence de très longs sarcomères, alors que les muscles du vol des drosophiles adultes contiennent des sarcomères courts et ne possèdent que des versions courtes de Sls.
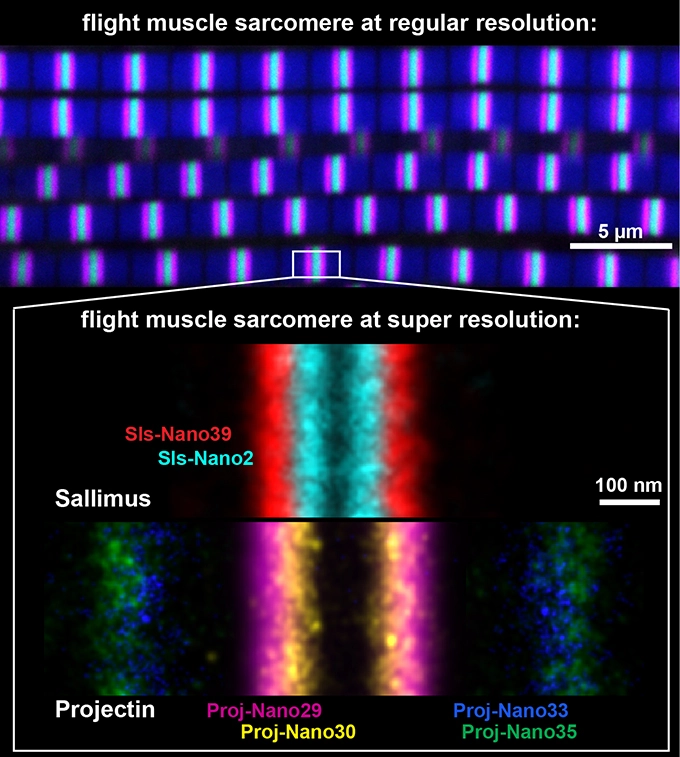
Pour mesurer plus précisément la position des protéines sarcomériques, Florian Schueder, du groupe de Ralf Jungmann à l’Institut Max Planck de biochimie de Munich, Pierre Mangeol à Marseille et Dirk Görlich à Göttingen, ont modifié les nanocorps afin qu’ils soient adaptés à une technique de microscopie à super-résolution appelée DNA-PAINT. Cette technique leur a permis de localiser des molécules individuelles dans les sarcomères avec une précision de 5 nanomètres. Ainsi, les emplacements exacts des deux homologues de la titine ont pu être mesurés avec précision, ce qui a révélé que l’extrémité de la courte Sallimus chevauche le début de la Projectin dans les sarcomères des muscles de vol (voir image). Ce résultat est intéressant car il suggère que les deux homologues de la titine de la drosophile partagent non seulement la fonction de la grande titine unique des mammifères, mais que leur orientation suggère qu’ils sont également connectés mécaniquement, , leur conférant une fonction identique à la grande protéine mammifères.
Un avantage unique des nanocorps est qu’ils peuvent être marqués avec des protéines fluorescentes et exprimés dans les muscles vivants des mouches. Grâce à cette méthode, Loreau et ses collègues ont pu étudier la dynamique de la titine Sallimus dans les muscles des larves : ils ont constaté que cette protéine est remarquablement stable. Une fois incorporée dans le sarcomère son replacement semble prendre bien de plus de 30 minutes. La combinaison des nouveaux outils générés ici ouvrira de nouvelles perspectives dans la recherche sur les sarcomères pour étudier la dynamique de l’assemblage et de la maintenance des sarcomères avec une résolution sans précédent dans le modèle de la drosophile.
Légende de la figure
En haut : Sarcomères de muscles de vol de Drosophile avec une résolution normale, visualisés grâce aux nanocorps marqués par fluorescence en microscopie confocale. L’actine est en bleu, une extrémité de la projectine en magenta, l’autre extrémité en vert. La barre d’échelle est de 5 µm.
En bas : Un assemblage de sarcomères de muscles de vol imagés avec des nanocorps par microscopie à super-résolution appelée DNA-PAINT. Les extrémités d’une version courte de l’homologue de la titine Sallimus sont en cyan (début Sls) et en rouge (fin Sls), tandis que la projectine est marquée en magenta et jaune (début Proj), et en bleu et vert (fin Proj). Chaque couleur a été générée par un nanocorps spécifique contre une petite partie des grandes protéines. Notez la superposition des positions des deux protéines. La barre d’échelle est de 100 nm.
En savoir plus
Loreau V, Rees R, Chan EH, Taxer W, Gregor K, Mußil B, Pitaval C, Luis NM, Mangeol P, Schnorrer F*, Görlich D*. (2023). A nanobody toolbox to investigate localisation and dynamics of Drosophila titins and other key sarcomeric proteins. eLife, e79343
https://elifesciences.org/articles/79343
Schueder F#, Mangeol P#, Chan EH, Rees R, Schünemann, J, Jungmann R*, Görlich D*, Schnorrer F*. (2023). Nanobodies combined with DNA-PAINT super-resolution reveal a staggered titin nano-architecture in flight muscles. eLife, e79344
https://elifesciences.org/articles/79344