L’équipe Maina publie dans Cell Death and Disease. Les chercheurs ont identifié un nouveau mécanisme de coopération génique à l’origine du carcinome hépatocellulaire.
Dans le cadre d’une collaboration avec les laboratoires des Drs K. Wangensteen (USA), G. Barrera et S. Pizzimenti (Italie), nous avons utilisé une méthode puissante pour transfecter in vivo des hépatocytes, dans un modèle de souris présentant des niveaux d’expression augmentés d’une RTK. Nous avons montré : 1) comment MYC et MET coopèrent, d’un point de vue fonctionnel, au cours du processus de tumorigenèse hépatique et 2) l’effet cytotoxique du ciblage combiné de MYC et MET, en comparaison à un effet cytostatique partiel obtenu lors du ciblage individuel. Les résultats obtenus peuvent être particulièrement pertinents pour un sous-groupe de patients atteints de CHC caractérisé par des niveaux élevés de MYC et MET, que nous avons identifié dans des cohortes distinctes.
Ce travail a été commenté par la Fondation ARC : MYC et MET, « Bonnie and Clyde » hépatiques…
MYC et MET coopèrent pour provoquer un carcinome hépatocellulaire présentant des caractéristiques moléculaires et des vulnérabilités distinctes
Résumé
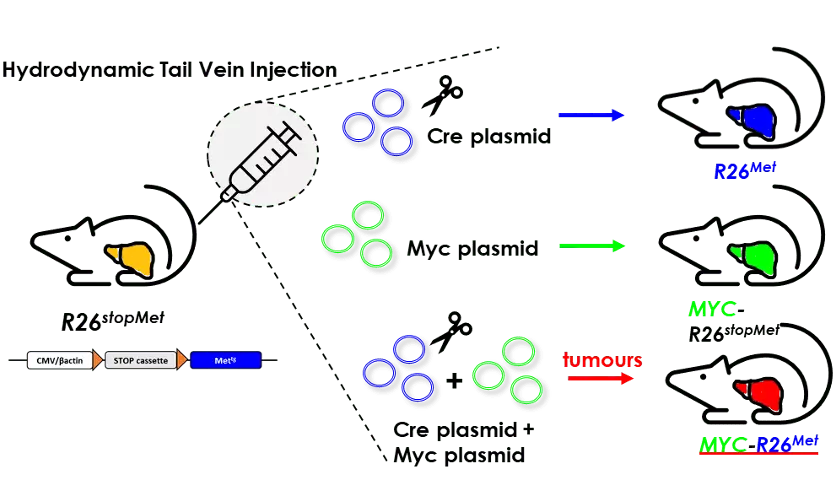
L’activation accrue du facteur de transcription MYC et du récepteur tyrosine kinase MET fait partie des événements fréquemment observés dans le carcinome hépatocellulaire (CHC). Chaque gène agit individuellement comme moteur de l’initiation et de la progression du cancer du foie. Cependant, leur altération concomitante dans le CHC n’a pas été explorée, ni documentée fonctionnellement. Ici, nous avons analysé les bases de données de cinq cohortes humaines indépendantes de CHC et avons identifié un sous-groupe de patients présentant des niveaux élevés de MYC et MET (MYC high/MET high) caractérisés par un mauvais pronostic. Cette observation clinique nous a poussé à explorer la fonctionnalité de la coopération entre MYC et MET in vivo. Pour cela, nous avons eu recours à un modèle génétique généré dans notre laboratoire (R26 stopMet), dans lequel les niveaux d’expression de MET de type sauvage sont augmentés suite à la délétion génétique d’une cassette stop. Nous avons réalisé une injection hydrodynamique dans la veine de la queue des souris R26 stopMet permettant ainsi l’expression de MYC dans ce contexte génétique. Les résultats ont montré que l’augmentation de l’expression de MYC et MET dans les hépatocytes est suffisante pour induire un processus de tumorigenèse hépatique, même en l’absence de lésions préexistantes, associées à un état pathologique chronique. De manière intrigante, l’expression ectopique de MYC dans les tumeurs MET augmente l’expression du marqueur de prolifération Mki67 et engendre la perte de Afp, Spp1, Gpc3, Epcam accompagnée d’une augmentation des niveaux de Hgma1, Vim et Hep-Par1. Nous avons également constaté un changement dans l’expression de points de contrôle immunitaires spécifiques, une augmentation des réponses de co-inhibition lymphocytaire Ctla-4 et Lag3 et des réponses de co-stimulation Icosl des cellules tumorales. Nous documentons in vitro la vulnérabilité de certaines lignées cellulaires humaines de CHC à un ciblage combiné de MYC et MET. D’un point de vue mécanistique, le blocage combiné de MYC et MET convertit un effet cytostatique partiel, déclenché par le blocage individuel de MYC ou MET, en un effet cytotoxique. L’ensemble de ces résultats met en évidence l’existence d’un sous-groupe de CHC caractérisé par MYC high/MET high et documente la coopérativité fonctionnelle entre MYC et MET dans la tumorigenèse du foie. Ainsi, nous montrons que le modèle MYC- R26 Met est pertinent pour étudier la biologie du CHC, la classification des patients et le traitement.
En savoir plus
Celia Sequera1,#, Margherita Grattarola1,2,#, Agnes Holczbauer3, Rosanna Dono1, Stefania Pizzimenti2, Giuseppina Barrera2, Kirk Wangensteen3,*, and Flavio Maina1,*
1 Aix-Marseille Univ, CNRS, Developmental Biology Institute of Marseille (IBDM), Turing Center for Living Systems, Parc Scientifique de Luminy, Marseille (France).
2 Department of Clinical and Biological Science, University of Turin, 10125 Turin (Italy).
3 Division of Gastroenterology, Department of Medicine, Mayo Clinic, Rochester, (USA).
# These authors contributed equally to this work.
Cell Death and Disease 2022 Nov 24;13(11):994. doi: 10.1038/s41419-022-05411-6.
Contact
Légende de la figure
L’augmentation concomitante de l’expression de MYC et MET dans des hépatocytes déclenche la tumorigenèse chez la souris. Le schéma illustre le protocole d’injection hydrodynamique dans la veine de la queue (HTVI) utilisé chez les souris R26 stopMet avec les plasmides Cre, Myc ou Cre+Myc.