L’équipe d’Alphée Michelot publie dans Plos Biology un article expliquant comment les cellules contrôlent la taille de multiples réseaux d’actine au sein d’un cytoplasme commun.
 Les cellules eucaryotes assemblent un grand nombre de structures d’actine à partir de molécules d’actine identiques. Ces structures d’actine coexistent au sein d’un cytoplasme commun et interviennent dans de multiples fonctions cellulaires. Le contrôle précis de la taille d’un réseau d’actine est important pour que la cellule puisse effectuer une fonction donnée de façon optimale, sans assemblage excessif d’actine. La compréhension des mécanismes moléculaires sous-jacents est aussi importante pour expliquer certaines réorganisations majeures du cytosquelette telles que la transition épithélio-mésenchymateuse. De tels processus requièrent un contrôle fin de multiples régulateurs de l’actine, tout déséquilibre biochimique pouvant faire basculer l’état des cellules et ainsi jouer un rôle dans le développement de cancers.
Les cellules eucaryotes assemblent un grand nombre de structures d’actine à partir de molécules d’actine identiques. Ces structures d’actine coexistent au sein d’un cytoplasme commun et interviennent dans de multiples fonctions cellulaires. Le contrôle précis de la taille d’un réseau d’actine est important pour que la cellule puisse effectuer une fonction donnée de façon optimale, sans assemblage excessif d’actine. La compréhension des mécanismes moléculaires sous-jacents est aussi importante pour expliquer certaines réorganisations majeures du cytosquelette telles que la transition épithélio-mésenchymateuse. De tels processus requièrent un contrôle fin de multiples régulateurs de l’actine, tout déséquilibre biochimique pouvant faire basculer l’état des cellules et ainsi jouer un rôle dans le développement de cancers.
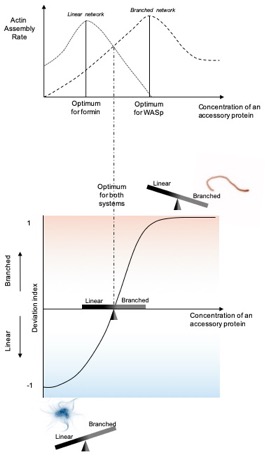
Une question essentielle du domaine était donc de comprendre comment les cellules peuvent contrôler simultanément la taille de multiples réseaux d’actine partageant une batterie protéines régulatrices communes. Afin de prédire comment la taille de deux types de réseaux d’actine distincts peut être contrôlée dans un environnement protéique commun, l’équipe a développé un système biomimétique minimal permettant l’assemblage simultané d’un réseau d’actine branché par le complexe Arp2/3 et d’un réseau d’actine linéaire par une formine. Les résultats obtenus ont montré que les protéines régulatrices de l’actine ont systématiquement un impact différent sur la vitesse d’assemblage des deux types de réseaux. Cependant, une interprétation simple de ces vitesses d’assemblage ne permettait en général pas d’expliquer les phénotypes observés lorsque l’activité de ces protéines était perturbée dans un modèle cellulaire simple (la levure, qui ne possède que ces deux structures d’actine). Par exemple, une réduction de la vitesse d’assemblage des deux réseaux sous certaines conditions pouvait très bien conduire à l’assemblage d’un cytosquelette d’actine normal.
L’équipe a alors montré qu’une interprétation satisfaisante de ces résultats est seulement possible lorsque les vitesses d’assemblage des deux réseaux sont comparées l’une à l’autre de façon relative. Ces résultats rappellent que les différents réseaux d’actine de la cellule ne s’assemblent pas de façon indépendante, mais sont en compétition l’un par rapport à l’autre pour l’assemblage de l’actine, et que seule une interprétation globale à l’échelle de tous les réseaux d’actine de la cellule n’a de sens.
Cet article propose donc un modèle général pour le contrôle de la taille des réseaux d’actine dans les cellules. Il offre ainsi à la communauté une perspective nouvelle pour comprendre comment des réorganisations complexes du cytosquelette d’actine peuvent se produire au cours de transitions cellulaires importantes.
En savoir plus :
-
Sizes of actin networks sharing a common environment are determined by the relative rates of assembly.
Adrien Antkowiak, Audrey Guillotin, Micaela Boiero Sanders, Jessica Colombo, Renaud Vincentelli, Alphée Michelot



