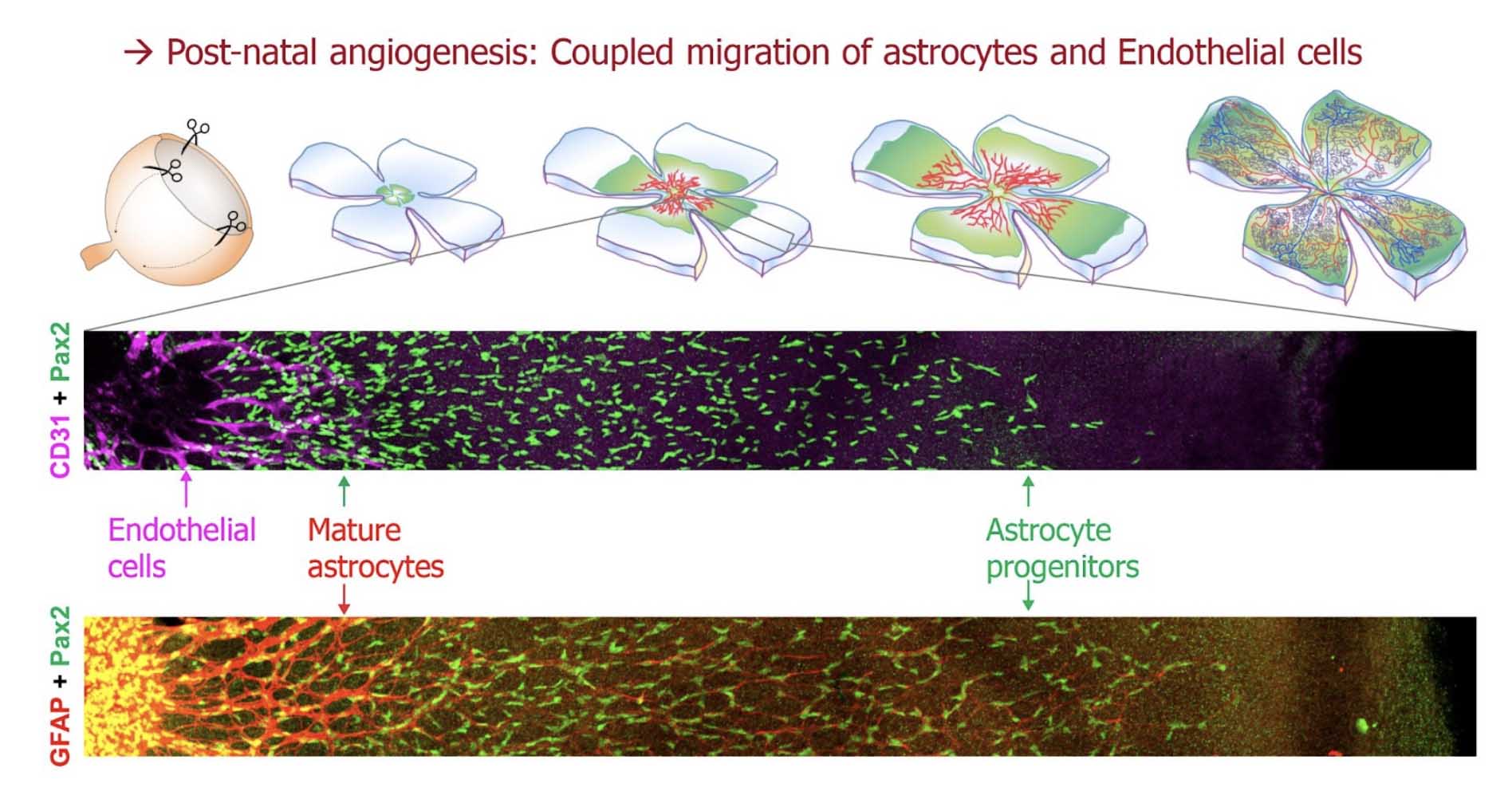
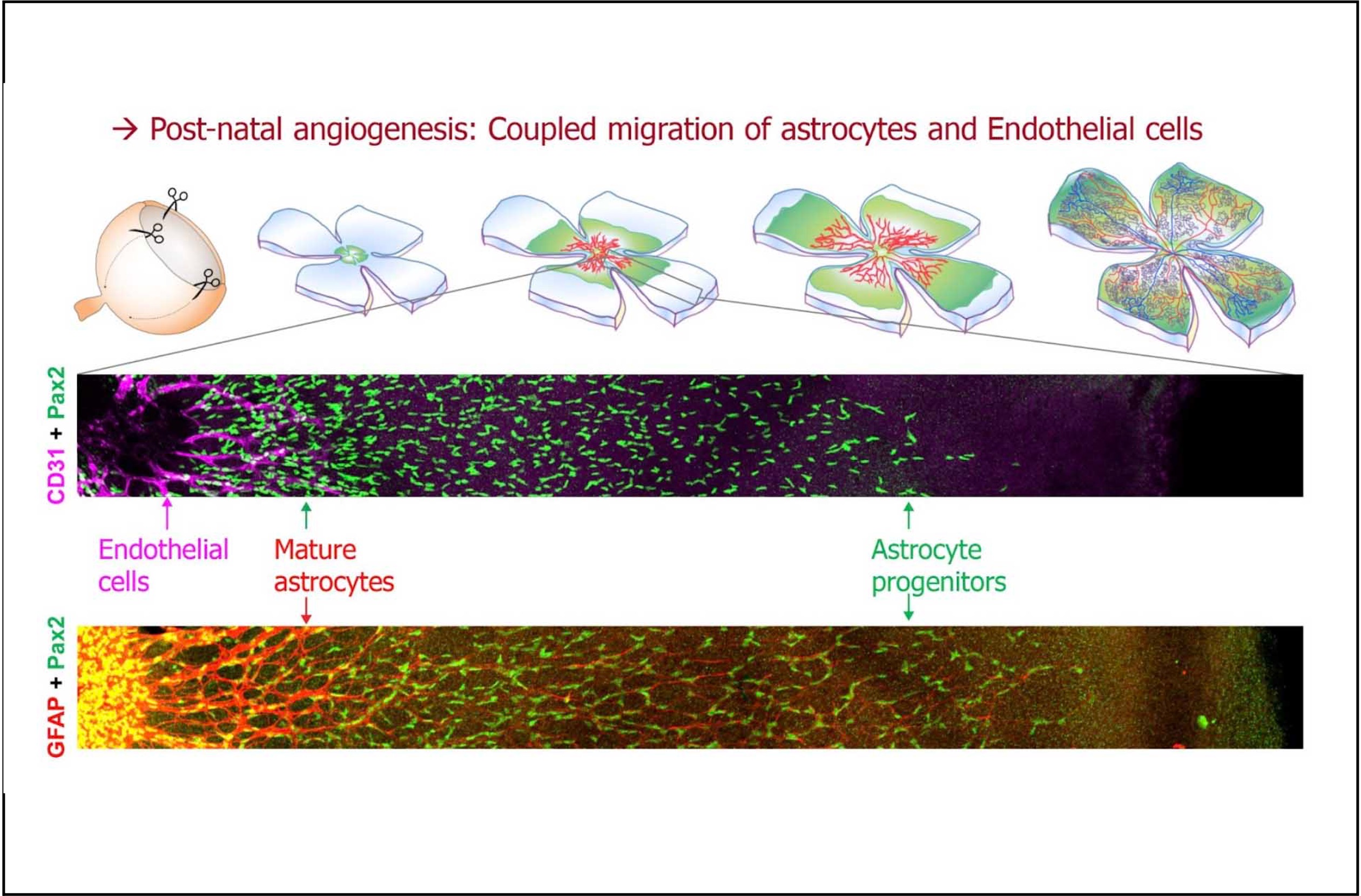
Les cellules endothéliales (CEs) représentent les unités de construction des vaisseaux sanguins, qui se forment au cours d’un processus appelé l’angiogénèse. Dans la rétine, l’angiogénèse implique une interaction entre les cellules endothéliales et des types cellulaires locaux tels que les astrocytes ou les neurones. La croissance des vaisseaux y implique la migration des cellules endothéliales sur un tapis d’astrocytes, lesquels migrent aussi de façon polarisée radiaire (depuis leur point d’entrée par le nerf optique vers la périphérie). Les deux événements de migration sont couplés par des mécanismes connus impliquant des échanges de signaux régionalisés entre astrocytes et cellules endothéliales. Ainsi, toute perturbation de la migration des astrocytes interfère également avec la progression angiogénique dans la rétine.
L’équipe Helmbacher a identifié la cadhérine Fat1 comme un nouveau régulateur de l’intégrité vasculaire, et a entrepris d’explorer les mécanismes sous-jacents. Une nouvelle étude publiée dans Development décrit comment une combinaison d’activités du gène Fat1 intrinsèques et extrinsèques aux astrocytes (identifiées grâce à des outils génétiques tissus-spécifiques et inductibles) influence le développement vasculaire dans la rétine, en modulant la polarité de migration, la prolifération et la maturation des astrocytes.